Excelで滴定曲線を書いてみよう3
二段階滴定の滴定曲線を考えてみよう。
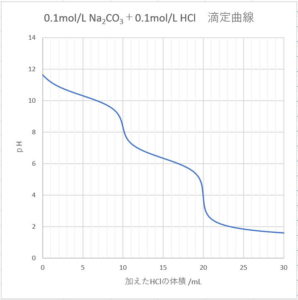
Na2CO3+HCl滴定曲線計算値 のエクセルファイル
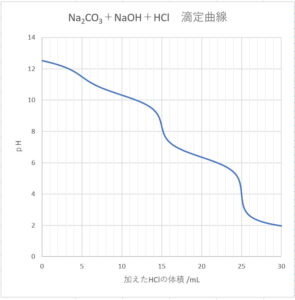
Na2CO3+NaOH+HCl滴定曲線計算値 のエクセルファイル
\( s \) mol/L Na2CO3 \( v_{0} \) mLに\( a \) mol/L HCl \( v \) mLを加えたときの滴定曲線
電離定数の計算から滴定曲線を書いてみよう。
HCl の体積\( v \) mLから[H+]を求めると,4次方程式を解くことになり,面倒。
[H+]から\( v \) を求めるなら,4次方程式ほどではない。
反応後の溶液の体積:\( v_{0}+v \) mLとする
反応前のNa2CO3の物質量は\( sv_{0} \) mmol
\( Cs=\displaystyle\frac{sv_{0} \sf{ mmol}}{(v_{0}+v)\sf{ mL}} \)=\(\displaystyle\frac{sv_{0}}{v_{0}+v} \) mol/L
反応前のHClの物質量は\( av \) mmol
\( Ca=\displaystyle\frac{av\sf{ mmol}}{(v_{0}+v)\sf{ mL}} \) =\(\displaystyle\frac{av}{v_{0}+v} \) mol/Lとする。
活量1,塩の電離度を1とすると
反応後のNa+の総量:\( 2sv_{0} \) mmol
[Na+]=\( 2Cs \) 式①
反応後のCl–の総量:\( av \) mmol
[Cl–]=\( Ca \) 式②
\( K_1 =\displaystyle\frac{\sf{[H^+][HCO_3^-]}}{\sf{[H_2CO_3]}} \)
\( K_2 =\displaystyle\frac{\sf{[H^+][CO_3^{2-}]}}{\sf{[HCO_3^-]}} \)
\( K_1×K_2 =\displaystyle\frac{\sf{[H^+]^2[CO_3^{2-}]}}{\sf{[H_2CO_3]}} \)
\(\sf{[H_2CO_3]}\)=\(\displaystyle\frac{\sf{[H^+]^2[CO_3^{2-}]}}{K_1K_2}\)
\(\sf{[HCO_3^-]}\)=\(\displaystyle\frac{\sf{[H^+]^2[CO_3^{2-}]}}{K_2}\)
式の簡略化のため \(a_1=\displaystyle\frac{ \sf{[H^+]^2} }{K_1K_2} \) \(a_2=\displaystyle\frac{ \sf{[H^+]} }{K_2} \)
\(\sf{[H_2CO_3]} \) = \(a_1\sf{[CO_3^{2-}]}\) 式③
\(\sf{[HCO_3^-]} \) = \(a_2\sf{[CO_3^{2-}]}\) 式④
溶液中に存在するC原子を含む物質は,Na2CO3から生じたものだから,
\(Cs\)とは,つぎの関係がある。
\(Cs\) =\(\sf{ [H_2CO_3] + [HCO_3^-] + [CO_3^{2-}]}\)
= \(a_1\sf{[CO_3^{2-}]}\) + \(a_2\sf{[CO_3^{2-}]}\) + \(\sf{[CO_3^{2-}]}\)
= \( (a_1+a_2+1) \sf{[CO_3^{2-}]}\)
\(Z =\displaystyle\frac{1}{a_1+a_2+1} \) とする。
\(Cs =\displaystyle\frac{\sf{[CO_3^{2-}]}}{Z} \)
\(\sf{[CO_3^{2-}]}\) =\( ZCs\) 式⑤
式④,⑤より
\(\sf{[HCO_3^-]}\) =\( a_2ZCs\) 式⑥
電気的中性条件より,陽イオンと陰イオンの濃度には,次のような関係がある
\(\sf{[Na^+]+[H^+]=[OH^-]+[HCO_3^-] + 2[CO_3^{2-}]+[Cl^-]}\) 式⑦
水のイオン積 \(Kw\)=\(\sf{[H^+][OH^-]}\)より
\(\sf{[OH^-]}\)= \(\displaystyle\frac{Kw}{\sf{[H^+]}}\) 式⑧
式⑦に①,②,⑤,⑥,⑧を代入する。
\(2Cs\)+\(\sf{[H+]}\) = \(\displaystyle\frac{Kw}{\sf{[H^+]}}\) +\(a_2ZCs + 2ZCs + Ca\)
\(W = a_2Z + 2Z\) とする。
\(2Cs\) +\(\sf{[H^+]}\) = \(\displaystyle\frac{Kw}{\sf{[H^+]}}\)+\( WCs +Ca\)
\(v\) が関係しているものを左辺に整理する。
\(2Cs - WCs - Ca\) = \(\displaystyle\frac{Kw}{\sf{[H^+]}}\) -\(\sf{[H^+]}\)
β= \(\displaystyle\frac{Kw}{\sf{[H^+]}}\) -\(\sf{[H^+]}\) とする。
\(Cs(2-W)-Ca\) =β
\(\displaystyle\frac{sv_0(2-W)}{v_0+v}\) - \(\displaystyle\frac{av}{v_0+v}\) = β
\(v =\displaystyle\frac{sv_0(2-W)-βv_0}{β+ a}\)
エクセルで,pH12~1の範囲で,\(\sf[H^+]\),\(a_1,a_2,Z,W,β\)を計算し,\(v\)を求める。
Na2CO3水溶液のpHを越えている範囲やHClのpHより小さい範囲(現実にはあり得ないpH)では,\(v\)はマイナスの値やあり得ない莫大な値になる。
Na2CO3 とNaOHの混合液に HClを加えたときの滴定曲線
\( s \) mol/L Na2CO3 \( v_{0} \) mLと\( b \) mol/L NaOH \( v_{1} \) mLに
\( a \) mol/L HCl \( v \) mLを加えたとき
基本的には,Na2CO3+ HClのときと同じ考え方
反応後の溶液の体積:\( v_{0}+v_{1}+v \) mLとする
反応前のNa2CO3の物質量は\( sv_{0} \) mmol
\( Cs=\displaystyle\frac{sv_{0} \sf{ mmol}}{(v_{0}+v_{1}+v)\sf{ mL}} \)=\(\displaystyle\frac{sv_{0}}{v_{0}+v_{1}+v} \) mol/L
反応前のNaOHの物質量は\( bv_{1} \) mmol
\( Cb=\displaystyle\frac{bv_{1} \sf{ mmol}}{(v_{0}+v_{1}+v)\sf{ mL}} \)=\(\displaystyle\frac{bv_{1}}{v_{0}+v_{1}+v} \) mol/L
反応前のHClの物質量は\( av \) mmol
\( Ca=\displaystyle\frac{av\sf{ mmol}}{(v_{0}+v_{1}+v)\sf{ mL}} \) =\(\displaystyle\frac{av}{v_{0}+v_{1}+v} \) mol/Lとする。
反応後のNa+の総量:\( 2sv_{0}+bv_{1} \) mmol
[Na+]=\( 2Cs+Cb \)
反応後のCl–の総量:\( av \) mmol
[Cl–]=\( Ca \)
ここから式③~⑧までは,Na2CO3+HClと同じ
NaOHが加わった分\(\sf{[Na^+]}\)が変化するので,
陽イオンと陰イオンの濃度の関係はつぎのようになる。
\(2Cs+Cb\)+\(\sf{[H^+]}\) = \(\displaystyle\frac{Kw}{\sf{[H^+]}}\) +\(a_2ZCs + 2ZCs + Ca\)
\(\displaystyle\frac{sv_0(2-W)}{v_0+v_1+v}\) - \(\displaystyle\frac{av}{v_0+v_1+v}\)+\(\displaystyle\frac{bv_1}{v_0+v_1+v}\) = β
\(v =\displaystyle\frac{sv_0(2-W)-βv_0-βv_1-bv_1}{β+ a}\)