NaClからNaを取り出す

電気分解で析出したNa単体
| 実験のポイント
NaClの融解塩電解は、身近な食塩から金属光沢のあるナトリウムが析出する劇的な反応であり、強く印象に残る。また、なじみ深い元素であるナトリウム単体の製法でもある。 |
準備
| (1)試薬について
特級NaClを用いる。市販の食塩は、炭酸マグネシウムが含まれているために、融解したときに液体が濁るので適さない。 |
|
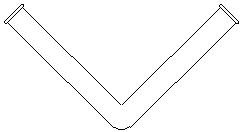 V字試験管 V字試験管 |
(2)電解容器について φ16.5mmの試験管(ホウケイ酸ガラス製)2本をV字に接合したものを用いる。通常のガスバーナーでは加工が大変かもしれないが、硬質またはホウケイ酸ガラスのガラス管を折り曲げたものでもよい。ビーカーなどで電解を行うと、生成したナトリウムと塩素が反応しないように、隔膜などの対策をしなければならない。V字試験管を用いたので、隔膜は不要である。 ホウケイ酸ガラスを加熱した場合、約700℃から黄色の炎色がガラスから出るようになり、さらに温度を上げるとガラス管の変形が始まる。ガラス管から黄色の炎色が出ないように加熱して融解すれば、容器はあまり変形しない。透明石英ガラス管(特注品4500円)であれば、変形の心配はない。 一度使用した試験管の再使用は、不可能である。 |
| (3)電極について 陽極は炭素、陰極はステンレスを用いる。隔膜のないV字試験管では、陽極で発生した塩素が陰極に回り込み陰極の鉄と反応して融解塩に色がつくことがある。深田ら2)によると、陰極にステンレス、モリブデン、タングステンを用いると良好な結果が得られるとのことである |
|
 |
(4)加熱器具について 通常のガスバーナーを3台用いる。簡単に融解することができる。ガスバーナー2台でも可能であるが、加熱が不十分なとき、片方の試験管で混合塩が固まり気体の逃げ口をふさぎ、他方の試験管に吹き出すことがある。 |
実験操作
| (1)試薬の準備
塩化ナトリウム(特級)16 gと無水塩化カルシウム(特級)24 gをよく混合する。 |
|
| (2)容器のセット
V字試験管をスタンドに取り付け、(1)の混合物を試験管に半分程度入れる。 |
|
 |
(3)加熱融解 バーナー3台でV字試験管を加熱し、塩を溶かす。試験管から黄色の炎色が出ない程度の炎で加熱する。この状態だと700℃くらいで加熱していることになる。 |
 |
(4)試薬の乾燥
すべての塩を溶かし終えたら、しばらく加熱して試薬中の水分を抜く。すぐに電解を行うと、陰極から多量の気泡が発生する。水素と思われるが確認できていない。 |
| (5)電極のセット
電極をバーナーであぶって加熱してから、試験管の中に入れる。炭素棒電極の内部に水分が付着していると、融解塩がはねて危険である。 |
|
 |
(6)電解
6.9 V、1 A程度で電気分解をする。 NaClの導電率(S・cm-1)4) |
 |
(7)陽極生成物の確認
陽極の気体をピペットで吸いとり、水で湿らせたヨウ化カリウムデンプン紙に吹きかけると青変する。 |
 |
(8)陰極生成物
10分程度電解する。装置の周りに塩素臭が漂う。陰極側の試験管は、黒くなって中が見えなくなることが多い。 陰極側の試験管を上からのぞくと、銀色の光沢を持つナトリウムが浮いているのが見える。 |

陰極の引き上げ
冷却後の試験管 |
(9)電解後 電解をやめ、電極を試験管から引き抜く。陰極を引き抜くと、電極に付着しているナトリウムが空気中の酸素と反応して、黄色の炎をあげて燃える。 加熱をやめて冷えてくると試験管がひび割れる。試験管と固まった塩の間にすき間ができる。液体の金属ナトリウムがこのすき間に入り込み、陰極の試験管が銀色に見える。試験管を割り水の中に入れると、ナトリウムが水面を走り回る。
|
参考文献
1) 吉澤四郎ほか,基礎無機工業化学,朝倉書店, p.53(1979)
2) 深田三郎,化学教育,31,(3),p.185,(1983)
NaClの融解塩電解の実験は、岩波映画の映像が有名である。バイコールガラス(耐熱は石英ガラスと同じくらい)のビーカーや耐火れんがの覆いなどを用いて行っている。電極に金属光沢のあるナトリウムが析出する映像がある。実際に実験をしてみるとなかなかできない。非常に貴重な映像である。
3) G.J.Janz,Molten Salts Handbook, Academic Press,p.276(1967)
4) 高橋武彦,新版電気化学概論,槇書店,p.222(1986)
